






こちらのページでは質量保存の法則・化学変化と熱の出入りについて解説しています!
イラストや図で要点をまとめながら分かりやすく解説しています!また、テストに出やすいポイントは赤文字やマーカーで表示しています。授業の予習復習や定期テスト対策にご活用ください!
質量保存の法則とは、化学変化の前後で全体の質量が変化しない法則のことをいいます。
例えば、7gの鉄が2gの酸素と反応したとき、発生する酸化鉄の質量は9gになります。

他の例として、炭酸水素ナトリウムと塩酸の化学変化を紹介します。

炭酸水素ナトリウムとうすい塩酸が混ざる と、二酸化炭素が発生し、塩化ナトリウムと水ができます。
反応によって発生した二酸化炭素を閉じ込めることができれば、この化学変化も反応の前後で質量は変わりません。
質量保存の法則と関係のある化学変化を2つご紹介します。
例えば、0.4 g の銅粉を加熱して質量変化を調べたところ、0.5 g になったところでそれ以上加熱しても質量は変化しなくなりました。これは一定量の銅と反応する酸素の質量は決まっているからです。
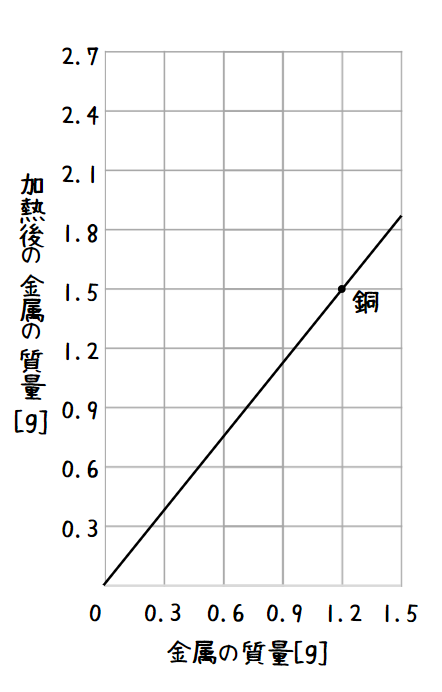
また、銅の質量と加熱後の酸化銅の質量には図のように比例の関係があります。
銅、反応 する酸素、加熱後の酸化銅の質量をできるだけ簡単な整数の比で表すと、
銅:酸素:酸化銅 =4 : 1 : 5 になります。
( ・ の場所を見ると、金属(=銅)の質量が1.2gの時に加熱後の金属の質量は1.5gになっています。よってここでは1.5 - 1.2=0.3gの酸素が加わったということになります。銅1.2g、酸素0.3g、酸化銅1.5gをそれぞれ比率に表すと1.2:0.3:1.5=4:1:5となります。)
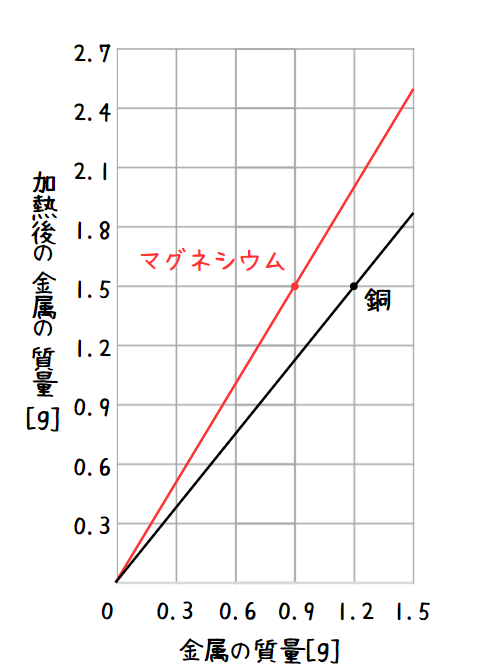
マグネシウムの質量と加熱後の酸化マグネシウムの質量にも図のように比例の関係があります。
マグネシウムの質量と反応する酸素の質量をできるだけ簡単な整数の比で表すと、マグネシウム:酸素:酸化マグネシウム =3 : 2:5になります。
( ・の場所を見ると、金属(=マグネシウム)の質量が0.9gの時に加熱後の金属の質量は1.5gになっています。よってここでは1.5 - 0.9=0.6gの酸素が加わったということになります。マグネシウム0.9g、酸素0.6g、酸化マグネシウム1.5gをそれぞれ比率に表すと0.9:0.6:1.5=3:2:5となります。)
ここまでの内容をもとに、次の図に関する問いに答えましょう!
①銅 0.8 gがすべて酸化すると、何 gの酸化銅ができるでしょう。
②銅 1.2 gと反応する酸素の質量は、何 gでしょう。
③銅 1.6 gと完全に反応する酸素の質量は、何 g でしょう。
④ある質量の銅 と 酸素 2 gが完全に反応した。何 g の酸化銅ができたでしょう。
⑤酸化マグネシウム 2.5 gをつくるには、何 g のマグネシウムが必要でしょう。
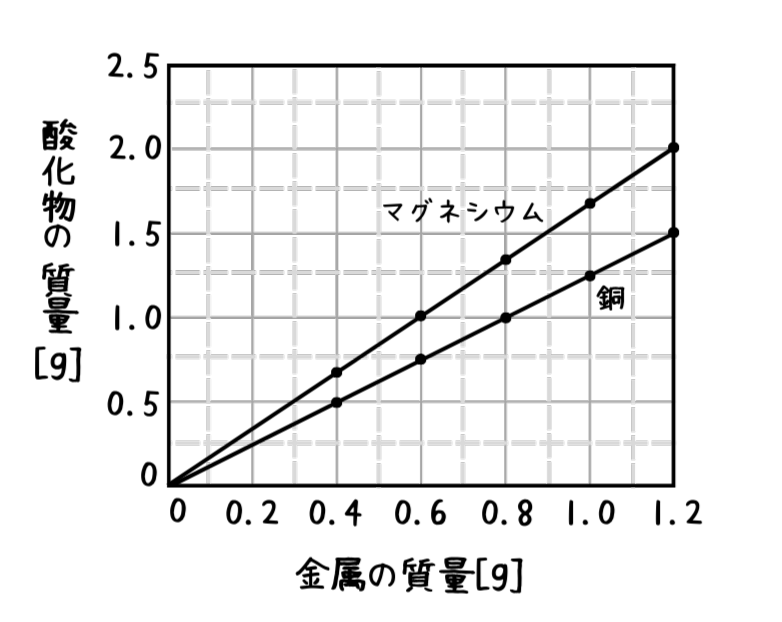
①.銅のグラフを読み取ると、銅が0.8gの時の酸化銅の質量は1.0gであることが分かります。よって答えは1.0gです。
続いて、発熱反応について解説します。発熱反応とは、化学反応のうち、熱を発生するもののことをいいます。
実は、私たちは発熱反応を身近なもので利用しています。それは携帯用のカイロです。カイロがあたたかくなるのは、カイロのなかに含まれる鉄が発熱反応を起こしているからなんです。
では、鉄の発熱反応について詳しく見ていきましょう。鉄は、酸素と化合する(つまり酸化する)ことで熱を発生させます。つまり、カイロの中で起きていたのは、カイロのなかの鉄が空気中に含まれる酸素によって酸化し、その際に起こる発熱反応であたたかくなっていたということです。
この発熱反応は鉄が酸化している時に起こります。そのため、かいろの中に含まれる鉄が全て酸化して酸化鉄になると、発熱反応がなくなり冷たくなっていきます。
他にも、発熱反応の例はいくつかあります。下の図にまとめたので確認しましょう!
\小・中・高校生の勉強にお悩みのある方へ/
熱を発生させる発熱反応と反対に、熱を吸収する化学変化を吸熱反応といいます。
吸熱反応の例を見ていきましょう。
最後までお読みいただきありがとうございました。
今回は質量保存の法則・化学変化と熱の出入りについて紹介しました、他にも理科の定期テスト対策の記事があるのでチェックしてみてください!他にも様々なお役立ち情報をご紹介しているので、ぜひご参考にしてください。質問などございましたら、お気軽にお問い合わせください!







